目前科学家已经能够制备出能量量子数 n 较大的氢原子。氢原子第 n 能级的能量为 ,其中
。图是按能量排列的电磁波谱,要使
的氢原子吸收一个光子后,恰好失去一个电子变成氢离子,被吸收的光子是( )
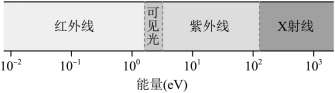
A .红外线波段的光子 B .可见光波段的光子
C .紫外线波段的光子 D . X 射线波段的光子
答案
A
【详解】要使处于 n =20 的氢原子吸收一个光子后恰好失去一个电子变成氢离子,则需要吸收光子的能量为
因为
则被吸收的光子是红外线波段的光子。
故选 A 。


 等。利用专门的仪器和方法,可以测得它们的波长分别为:红色的
等。利用专门的仪器和方法,可以测得它们的波长分别为:红色的 线,波长为656.3nm;蓝绿色的
线,波长为656.3nm;蓝绿色的 线,波长为486.1nm;青色的
线,波长为486.1nm;青色的 线,波长为434.1nm;紫绿色的
线,波长为434.1nm;紫绿色的 线,波长为410.2nm
线,波长为410.2nm
 式中R叫做里德伯常量,
式中R叫做里德伯常量, 这个公式称为巴耳末公式,它确定的这一组谱线称为巴耳末系。式中的n只能取整数,不能连续取值,波长也只会是分立的值
这个公式称为巴耳末公式,它确定的这一组谱线称为巴耳末系。式中的n只能取整数,不能连续取值,波长也只会是分立的值

